16/03/2024 | Activité Physique, Hepatologie, Cirrhose, Steatose, Médecine Générale et Familiale, Obesité
Le Jeudi 14.03.2024, les autorités sanitaires américaines ont approuvé le premier traitement contre la forme grave de la stéatose hépatique. Une maladie qui touche des millions de personnes aux États-Unis.
Il est désormais permis d'administrer le traitement "Rezdiffra", aux adultes atteints de Stéatohépatite Non Alcoolique et à ceux souffrant de cirrhose du foie.
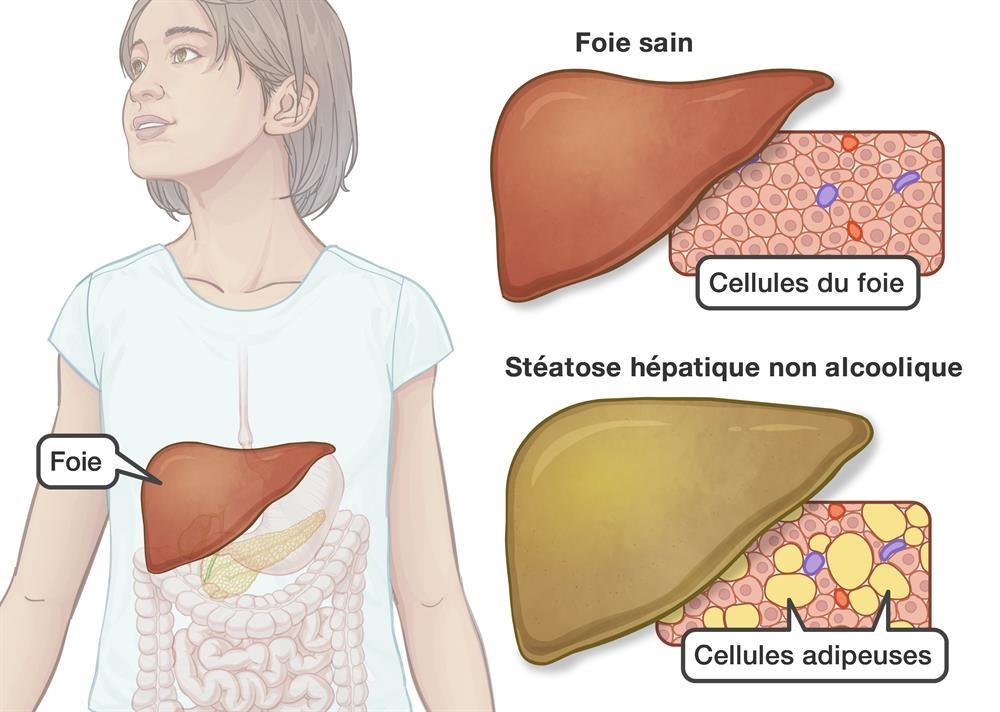
La Stéato Hépatite Non Alcoolique (SHNA) se manifeste par une accumulation anormale de graisse dans le foie. Cette accumulation entraîne une inflammation chronique de cet organe. Ses cellules sont progressivement remplacées par une fibrose. La fibrose hépatique est un tissu cicatriciel pouvant se transformer en cirrhose du foie, voire en cancer ( NASH Evolution).

Il s’agit d’une maladie étroitement liée à l’obésité. Elle représentant un énorme marché pour les groupes pharmaceutiques. Une personne sur deux développe une stéatose et certains facteurs peuvent aggraver le risque de fibrose. Le diabète ou l’hypertension artérielle sont des exemples.
D’autres facteurs peuvent également faciliter la contraction de la maladie : régime alimentaire, manque d’activité physique ou facteurs génétiques.
L'American Liver Foundation a déclaré que la décision de la FDA "apporte de l'espoir à des millions d'Américains".
La Stéatohépatite Non Alcoolique devrait devenir la principale cause de transplantation hépatique aux États-Unis d’ici 2025.

Environ 6 à 8 millions d'Américains sont susceptibles d'être concernés par ce nouveau traitement, un nombre qui devrait continuer à augmenter, selon la FDA.
En France, les données de la Cohorte Constance de 2020 estiment que 220 000 personnes souffriraient d’une fibrose avancée pré-cirrhotique ou d’une cirrhose. Un chiffre qui pourrait plus que doubler d’ici 2030, selon certaines projections.
Jusqu'ici, ces patients "n'avaient pas de médicament pouvant agir directement sur les dommages à leur foie".
Le traitement est pris par voie orale une fois par jour, en plus de suivre un régime alimentaire approprié et de faire de l'exercice.
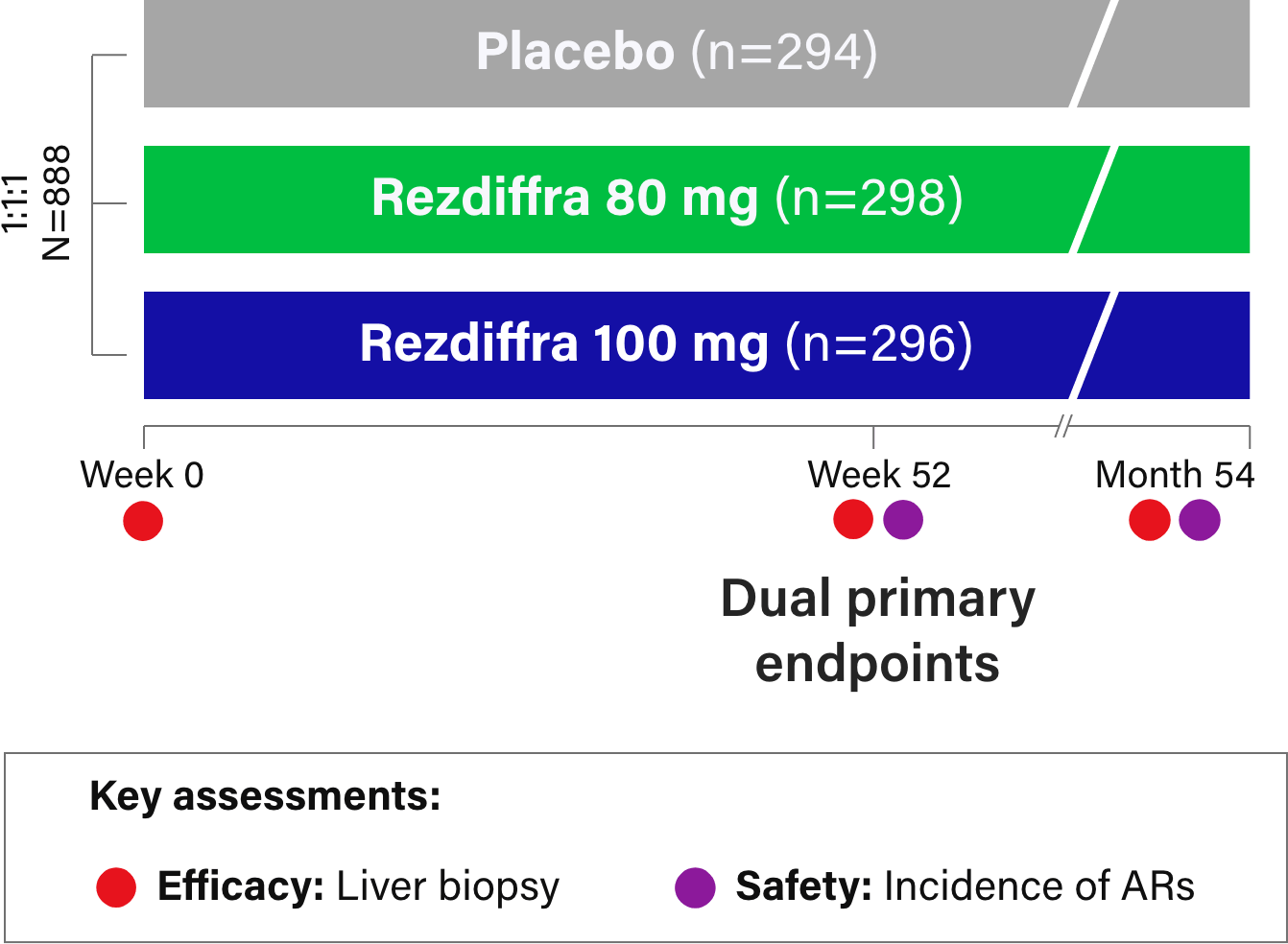
L'autorisation était basée sur un essai clinique mené auprès d'environ 900 personnes et, après 12 mois. Elle a montré un bénéfice pour ceux qui ont reçu le traitement, par rapport aux autres qui ont reçu un placebo.
Les effets secondaires les plus courants étaient la diarrhée et les nausées.
La société a indiqué que le traitement serait disponible pour les patients aux États-Unis à partir d'avril prochain dans les pharmacies spécialisées.

28/07/2024 | Médecine Générale et Familiale, Nephrologie, Insuffisance Rénale

26/07/2024 | Diabète, Médecine Générale et Familiale, Nutrition et bien-être
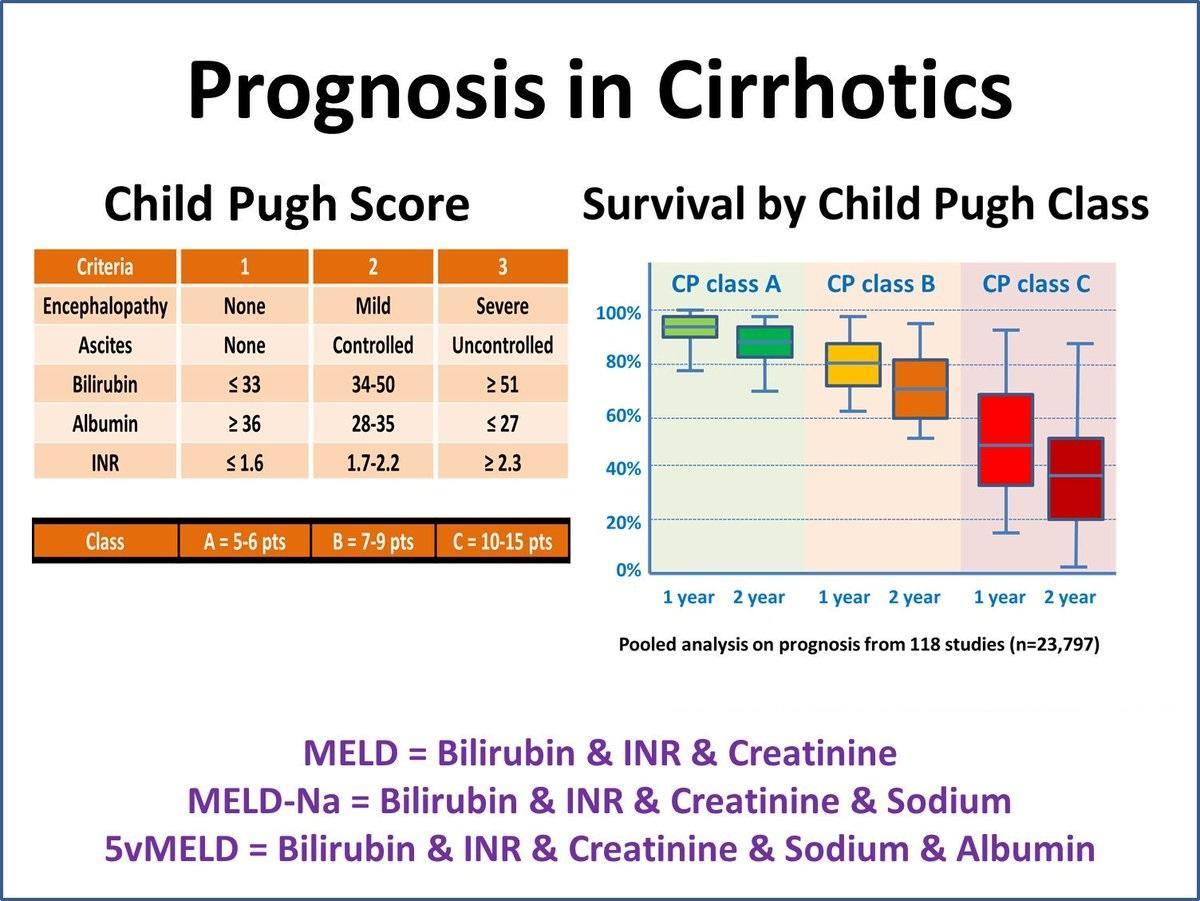
14/03/2024 | Alcoolisme, Cancerologie, Hepatologie, Cirrhose, Score MELD